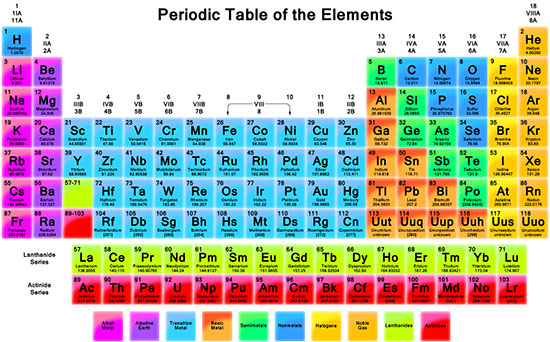
جدول تناوبی عناصر (مندلیف) نمایشی نموداری (جدولی) از عناصر شیمیایی بوده که بر اساس افزایش عدد اتمی طراحی شده است. این جدول دارای 7 تناوب (دوره) و 18 گروه بوده که در آن عناصر با خواص مشابه در یک ستون و عناصر با تعداد یکسان الکترون در لایه آخر، در یک دوره (تناوب) قرار می گیرند.
تعداد 118 عنصر در جدول تناوبی قرار داشته که از این تعداد، 114 عنصر شناخته شده است. هر دوره با یک فلز قلیایی آغاز و به یک گاز بی اثر ختم می گردد، برخی از خواص عناصر جدول تناوبی به صورت متناوب و دارای روندی خاص هستند. عناصر موجود در جدول بر اساس خواص فیزیکی و شیمیایی شان به چند دسته طبقه بندی شده اند که عبارت است از:
1- فلزات قلیایی
2- فلزات قلیایی خاکی
3- فلزات واسطه داخلی
4- فلزات واسطه خارجی
5- شبه فلزات
6- فلزات ضعبف
7- هالوژن ها
8- گازهای نجیب
8 گروه عناصر اصلی را با پسوند A و 10 گروه فلزات واسطه خارجی را با پسوند B کد گذاری کرده اند.
دیمتری مندلیف
دیمتری مندلیف در 8 فوریه سال 1834 در سیبری به دنیا آمد و در 2 فوریه سال 1907 در سن پترزبورگ فوت کرد. او در سال 1856 تحصیلات آکادمیک خود را به پایان رساند و موفق شد در سال 1864 به درجه استادی انستیتو تکنولوژی سن پترزبورگ نائل شود و در سال 1865 استاد دانشگاه ایالتی سن پترزبورگ شد. او اولین کتاب خود را در زمینه اسپکتروسکوپی در سال 1861 نوشت. بیشترین معروفیت مندلیف به دلیل ارائه جدول تناوبی می باشد که در آن 63 عنصر شناخته شده را بر اساس وزن اتمی شان به شکل یک جدول تناوبی مرتب کرد و با عنوان اصول شیمی در سال 1869 به چاپ رساند.

تاریخچه جدول تناوبی عناصر
جدول تناوبی به شکلی که امروزه در دسترس می باشد، از ابتدا به این صورت نبوده و طی سال های بسیاری گسترش یافته است.
گرچه منابع، دیمتری مندلیف را اولین دانشمندی معرفی کردند که عناصر را بر اساس وزن اتمی شان به صورت جدول مرتب کرد اما تا قبل از آنچه مندلیف ارایه کرده بود، تاریخچه ای در این مورد وجود دارد که در زیر خلاصه ای از آن آورده شده است.
در سال 1669 بازرگان آلمانی و کیمیاگر مبتدی به نام Hennig Brand تلاش کردند سنگ فیلسوف را کشف کنند، چیزی که ظاهرا می توانست فلزات را به طلای خالص تبدیل کند. او اولین نفری بود که فسفر را کشف کرد. در سال 1680 Robert Boyle، نیز فسفر را کشف کرد و این عنصر به عموم شناخته شد.
در سال 1809 ، حداقل 47 عنصر کشف شده بود که دانشمندان سعی می کردند آنها بر اساس مشخصاتشان دسته بندی کنند.
در سال 1863 شیمیدان انگلیسی John Newlands ، عنصر کشف شده را بر اساس مشخصاتشان به 11 گروه تقسیم کرد.
در سال 1869 شیمیدان روسی Dimitri Mendeleev، بر اساس وزن اتمی عناصر را رده بندی کرد. او کشف سایر عناصر را نیز پیش بینی کرد و فضایی را برای آنها در جدول تناوبی خود در نظر گرفت.
در سال 1886 فیزیکدان فرانسوی Antoine Bequerel ، اولین بار رادیو اکتیویته را کشف کرد. Marie و Pierre Curie روی تابش اورانیم و توریوم تحقیق کردند و در ادامه رادیم و پولونیم را کشف کردند.
در سال 1894 Sir William Ramsay و Lord Rayleigh گازهای نجیب را کشف کردند که به عنوان گروه 0 به جدول تناوبی اضافه شدند.
در سال 1897 فیزیکدان انگلیسی J. J. Thomson اولین بار الکترون (ذره با بار منفی در یک اتم) را کشف کرد.
در سال 1913 Bohr کشف کرد که الکترون ها به دور یک هسته با انرژی های مختلف می چرخند که آنها را اربیتال نامید. تابش در حین حرکت آنها از یک اربیتال به اربیتال دیگر ساتع می شود.
و در سال 1945 Glenn Seaborg لانتانیدها و آکتنیدها (عدد اتمی > 92) را شناسایی کرد که معمولا در زیر جدول تناوبی گذاشته می شوند.

![]()
![]()
![]()






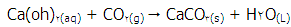


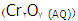 به 3+ در یون سبر رنگ کروم
به 3+ در یون سبر رنگ کروم